多階層感覚構造研究室の最終的な目標は、遺伝子、分子、細胞種、回路、神経計算など、より低次の階層におけるメカニズムに基づいて、脳機能が創発する基本原理を理解することです。このような階層縦断的研究により、遺伝子修復の対象となるような神経疾患において変容している細胞種や回路を特定し、さらには、種あるいは系統特異的な脳機能の原因となるゲノムの違いを特定することが可能になります。網膜を始点とした視覚系は、このような目的を達成するための理想的なモデルであると考えています。
現在行っているプロジェクト
プロジェクト1ー シナプス特異性創発の分子機構及び神経活動依存性機構
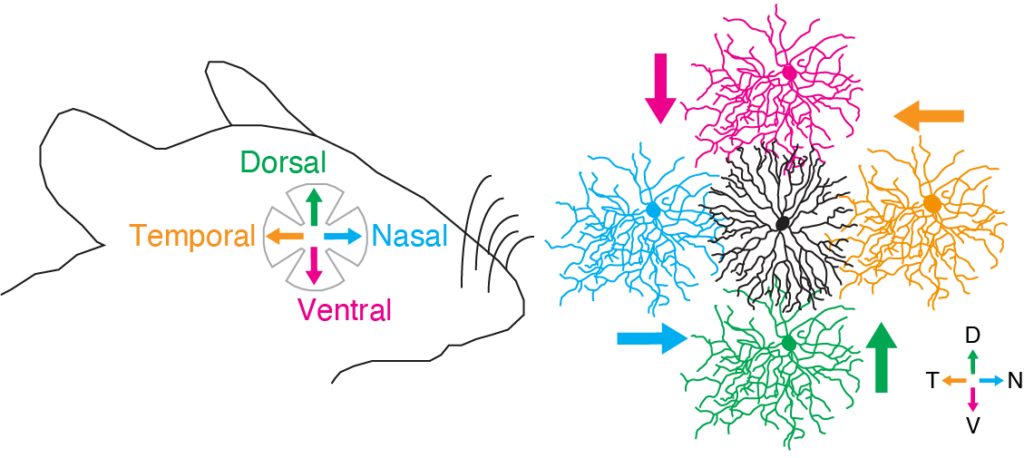
動物の体は、厳密な遺伝的プログラムによって体軸に沿って整然と形成されます。神経接続にも体軸に沿った特異性があり、特に接続の空間的非対称性は感覚情報処理の基本要素です。網膜の方向選択性(DS)細胞は、視覚的な動きの方向に選択的に反応する性質を持ち、オプティックフローの検出と視運動性眼球反射の制御に関与しています。 網膜のスターバースト細胞の突起は、4種類のDS細胞(それぞれが背側、腹側、鼻側、耳側の方向に選択性を持つ)に対して、突起角度依存的な抑制性シナプスを形成します。この非対称的な抑制性接続は、網膜の方向選択性を支える重要なメカニズムの一つであり、生後1~2週間の開眼前に発達します(Yonehara et al., Nature 2011)。
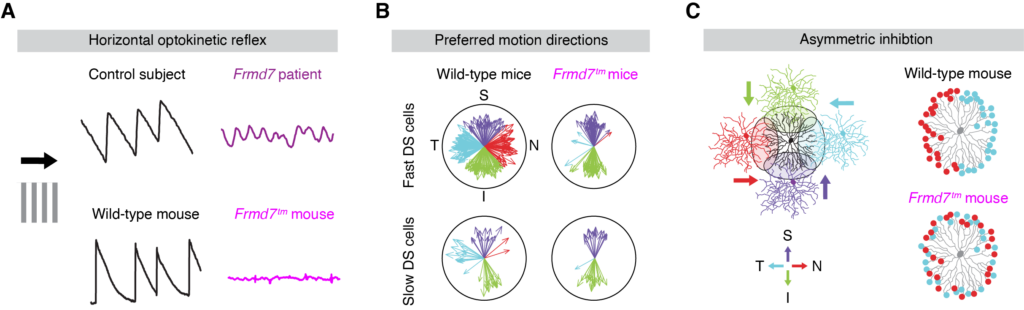
以前に我々は、先天性眼振の原因遺伝子として知られるFrmd7が、水平非対称な抑制性接続の発達に必須であることを発見しました(Yonehara et al., Neuron 2016)。加えて、我々は他にもいくつかの重要な細胞膜タンパク質や転写因子を同定しています(未発表)。現在の我々の仮説は、これらの分子が協調して空間非対称なシナプス形成を行うことで、神経自発活動の伝搬(retinal wave)の時空間パターンを規定すると考えています。実際、retinal waveが水平方向の方向選択性発達に必須であることが示されています。一方向性に伝搬するretinal waveによって時空間特異的なシナプス活動パターンが生まれ、それがヘブ則に従うシナプス可塑性を介して、スターバースト細胞からDS細胞のシナプス特異性を創発すると予想しています。
このような研究を行うために、ES細胞のジーンターゲティング法や接合子のゲノム編集法を用いた遺伝子改変マウス開発、遺伝研の恵まれた動物施設を活用した大規模マウス遺伝学、生化学、細胞生物学、トランスクリプトミクス、プロテオミクス、電気生理学、マクロイメージング、2光子機能イメージングなど、さまざまな技術を組み合わせています。
プロジェクト2ー 網膜における視覚情報処理の神経回路機構
我々はこれまでに、哺乳類の網膜における視覚運動情報処理に重要な神経回路メカニズムを同定してきました。まず、網膜から2光子グルタミン酸イメージングを行い、興奮性介在ニューロンである双極細胞からDS細胞への時空間接続(Space-time wiring)を同定し、この興奮性回路モチーフがDS細胞の速度チューニングの基盤となることを示しました(Matsumoto et al. Curr Biol 2019) 次に、DS細胞の樹状突起から2光子アセチルコリンイメージングを行い、樹状突起の微小セグメントレベルにおける興奮性/抑制性入力のバランスが、方向選択性の計算に重要であることを示しました(Sethuramanujam et al, Nat Commun 2021)。その後、網膜における方向選択性が双極細胞の軸索末端ですでに計算されているという予期せぬ発見をしました(Matsumoto et al. Neuron 2021)。 軸索は信号を伝達する単純な導管と考えられがちなので、感覚刺激に対するチューニングが軸索末端でまず発生するというのは意外な発見でした。さらに最近、内網状層から2光子GABAイメージングを行い、40以上の機能的GABA作動性アマクリン細胞種が存在し、それらの細胞種固有の時空間動態のおかげで、行動学的に意味のある多様な視覚演算を可能にしていることを明らかにしました(Matsumoto et al. Nature Neuroscience 2025)。現在は、網膜の多様な視覚演算が生まれてから死ぬまでの生涯でどのように変容するのかを明らかにする研究を行っています。
このような研究を行うために、ラボに2台ある摘出網膜用2光子イメージングシステム、細胞種が標識された遺伝子改変動物、パッチクランプ記録、機械学習を援用したデータ解析を組み合わせています。重要なことに、アメリカや中国のグループから未発表の神経伝達物質センサーを受け取り、いち早く実験を行うための体制を確立しています。
プロジェクト3ー 上丘や大脳皮質における感覚情報処理と行動制御
マウスの上丘は、網膜からの視覚入力が視覚に依存した生得的行動にどのように変換されるかを理解するための理想的なモデル系である。最近、上丘細胞の明暗と動きへの応答が統計学的に相関がないことを発見し、これが網膜から上丘への情報変換の基本原理であることが示唆されました(Schwartz et al., bioRxiv 2023)。現在は、頭位固定下でのin vivo 2光子イメージング、自由運動下での頭上装着型マイクロ内視鏡によるイメージング、経シナプス標識、行動解析などを行い、上丘の細胞タイプや回路の機能を解明する予定です。
我々は、網膜ON-OFF DS細胞からの信号が高次視覚野のRL領域に選択的に到達すること(Rasmussen and Matsumoto et al., Nat Commun 2020)、この領域の両眼からの網膜DS細胞からの信号の組み合わせによって回転性視覚流動に対する反応性が形成されることを見出しています(Rasmussen and Matsumoto et al., Curr Biol 2021)。 RLにおける運動情報処理の回路機構とその行動への寄与について、今後も研究を続けたいと考えています。
また、新たな取り組みとして、視覚神経回路の環境適応の遺伝的メカニズムの理解を目指したプロジェクトを新たに開始しました。遺伝研の小出剛先生が管理されている、世界中から集められた様々な系統の野生マウスについて、DeepLabCutを用いた行動トラッキングにより様々な視覚依存性行動(獲物狩りや逃避防衛行動など)を比較しています。
このような研究を行うために、ラボに2台ある生体内2光子イメージングシステム、ラボに1台あるマウスの頭に装着可能であり自由行動下でのイメージングを可能にするMINI2P(Thorlabs)、ラボに一台あるInscopixの1Pミニスコープ、細胞種が標識された遺伝子改変動物、DeepLabCutを利用した行動の定量解析を組み合わせています。